Metode de determinare a primei ordine constanta vitezei de reacție, și
Secțiunea 5. Cinetica reacțiilor chimice și a cataliza.
Nu întotdeauna reacții termodinamic posibile sunt efectuate în realitate. Acest lucru se datorează faptului că, în termodinamica este nici un parametru de timp, astfel încât să nu dea un răspuns imediat ce apare această condiție. Determinarea condițiilor în care este posibil, termodinamic va curge cu o viteză suficientă reacția este una dintre principalele probleme ale cinetica chimică. Cinetica factorul timp este introdus, care in termodinamica nu este considerat.
cineticii chimice - predarea regularitățile procesului chimic în timp sau de predare privind mecanismul și viteza reacțiilor chimice.
Setul de măsuri care constituie mecanismul de reacție chimică sau schemă se numește o reacție chimică.
Rata de reacție chimică.
Sub viteza reacției chimice înțeleg variația numărului de moli de reactanți per unitate de timp per unitate de volum.
Viteza medie - modificare a concentrației reactanților într-o anumită perioadă de timp:
atitudine # 916; c / # 916; t poate fi pozitiv sau negativ. Viteza poate fi măsurată prin observarea reducerii concentrației compusului inițial, atunci setul raportul înainte de semnul minus, deoarece viteza este întotdeauna o cantitate pozitivă. Dacă viteza exprimată în termeni de concentrație a materialului de primire, semnul plus:
Aceasta poate fi atribuită modificarea concentrației intervalului de timp infinitezimal (t2 -T1 → 0), determinarea ratei de reacție adevărată la momentul ca derivat al concentrației în timp (u = ± dc / dt).
Dependența vitezei de reacție asupra concentrației.
Postulatul de bază a cineticii chimice este legea acțiunii de masă, setați Guldberg și Vahe. Luați în considerare reacția chimică:
Ecuația care descrie dependența reacției chimice asupra concentrației componentelor vitezei amestecului de reacție, ecuația cinetică se numește reacție chimică.
Ecuația cinetică a acestei reacții:
unde k - factorul de proporționalitate (viteză constantă).
Legea acțiunii maselor: rata de reacție chimică la fiecare punct în timp este direct proporțională cu produsul concentrațiilor reactanților, la un anumit moment de timp în grade, corespunzător coeficienții stoechiometrici ai reacției (în cel mai simplu caz).
În cele mai multe cazuri, nu rata, și constanta vitezei de numărare. Când CA = CB = 1 mol / l, u = k.
Sensul fizic al constantelor de viteză ale constantei vitezei de reacție a vitezei de reacție chimică este numeric egală cu condiția ca concentrația reactanților constantă și egală cu unitatea. Constanta ratei nu depinde de concentrația depinde de temperatura și natura solventului și prezența catalizatorului.
Toate reacțiile sunt cinetic bilaterale sau cinetic reversibile. Reacția chimică este reversibilă, în cazul în care produsele de reacție pot reacționa între ele, formând materii prime. În practică, reculul poate fi atât de lent în comparație cu directe că orice reversibilitatea o precizie rezonabilă a reacției poate fi neglijată și considerată ca o reacție ireversibilă, sau o singură față. Strict vorbind, toate sunt reacții chimice reversibile:
La momentul echilibrului chimic u1 = u2, adică
unde K - echilibrul chimic constant egal cu raportul dintre constanta de viteză pentru constanta vitezei de reacție față a reacției inverse.
Clasificarea reacțiilor în moleculare și ordine.
In studiul cineticii reacțiilor chimice diferă în moleculare și ordine.
reacția Molecularity este determinată de numărul de molecule simultan participante la etapa care determină viteza tuturor reacției (cel mai lent). Conform acestei caracteristici a reacției este separat într-un mono-, bi- și trimolecular. Reacțiile ca moleculară mai mare practic necunoscute, ca probabilitatea de a satisface cele patru molecule este neglijabilă.
Ordinea de reacție este determinată de suma exponenților concentrației în termenii legii acțiunii maselor. Distinge complet (partajat) și private ordinea de reacție (pentru fiecare reactiv). Suma exponenților în care concentrația tuturor materialelor de pornire sunt incluse în ecuația cinetică, definește ordinea totală. Distinge reacție zero, prima, a doua, a treia și ordinele de fracționare.
Coincidență molecularity ordinea se observă numai în cazurile cele mai simple, atunci când are loc reacția într-o singură etapă:
ordin general - 3, molecular - 3.
5.3.1. Ecuația reacției de prim ordin.
Luați în considerare reacția chimică: A → B.
Se separă variabilele: -ds / s = k dt, integrarea
dacă # 964; = 0 (momentul inițial al reacției), apoi c0 = ln const. și anume
ln c0 - ln c = kt sau ln c0 / s = kt,
Fie x - transformarea materialului de pornire: x = c0 - c.
Dimensiunea - [timp -1].
constantă Mai întâi de viteză de ordinul de reacție este independentă de concentrație. Poate fi substituit în concentrația ecuația rezultată (mol / l) pot fi alunițe. În loc de „c0“ și „(c0 - x)“ poate înlocui orice valoare proporțională cu concentrația (conductivitate, densitatea, vâscozitatea etc.).
Pentru a caracteriza viteza de viteza de reacție de ordinul întâi constantă alături de multe ori folosesc o cantitate numită timp de înjumătățire.
Timpul de înjumătățire (t1 / 2) - un interval de timp în care reacționează cantități jumătate luate:
Timpul de înjumătățire nu depinde de concentrațiile inițiale și depinde de constanta de viteză, adică este caracteristic reacțiilor de prim ordin.
Pentru reacțiile de prim ordin sunt reacțiile de dezintegrare radioactivă, izomerizare, reacțiile de hidroliză majoritatea. Atunci când un exces mare de unul dintre reactanți, comparativ cu cealaltă, concentrația sa rămâne practic constantă în timpul reacției. În acest caz, ordinea reacției va fi una mai mică decât ar fi de așteptat prin ecuația stoechiometrică.
Reacțiile bimolecular în care ordinea reacției, din cauza unui exces de unul dintre reactanți este diminuat cu o unitate numită pseudomolecular.
Exemplu reacție de descompunere hidrolitica într-o soluție apoasă diluată de zahăr (inversiune zahăr):
fructoza glucoza caharoza
u = k [zaharoză] „[H2O],
dar apa este în exces și se poate presupune că [H2O] = const. atunci
u = k * [zaharoză], unde k * = k '[H2O].
Aceasta este o pseudo-prim ordin reacție exemplu.
Ecuația sided reacție de ordinul doi.
1. Metoda ecuațiilor de selecție.
Metoda constă în substituirea datelor experimentale asupra concentrațiilor de substanțe pentru fiecare moment de la începutul reacției în ecuațiile cinetice ale diferite ordine (această metodă nu face nimic dacă ordinea reacției este mai mare decât 3 sau fracționată)
Ordinea reacției va corespunde ecuației cinetice pentru care, la diferite concentrații inițiale ale materiilor prime și la momente diferite, la o temperatură dată, va fi o constantă de viteză constantă.
2. Metode integrale grafice.



ordin zero: prima comandă de ordinul doi
Fig. 5.1. Modificarea concentrației în timp pentru reacțiile
Găsiți o funcție de concentrare, punând că pe diagramă, în funcție de timp, pentru a primi o linie dreaptă (fig. 5.1.).
3. La jumătate de perioadă.
Prin semiperioadă în funcție de concentrația inițială:
ordinul întâi: t1 / 2 = 0,693 / k;
Experimentele efectuate la două concentrații inițiale diferite (C0) „și (C0)„:
Paravane (1) (2):
4. Metoda diferențială (metoda van't Hoff).
Utilizarea dependența de concentrație a vitezei de reacție în condițiile egalității concentrațiile tuturor materiilor prime (figura 5.2 ..): U = kc n. Logaritm expresie dată: LGU = LGK + nlgs.
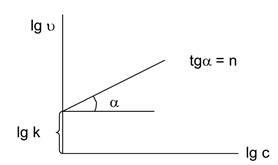
Fig. 5.2. Dependența vitezei de reacție asupra concentrației.
5. Metoda Integral Van't Hoff (în funcție de viteza de reacție a concentrației inițiale în primele momente ale timpului - 10-15 s).
Deoarece prima dată x ≈ 0.
Experimentele conduită cu diferite concentrații inițiale.
unde c1 și c2 sunt luate la porțiunea de mijloc a răspunsului de testare corespunzător # 916; t.
6. Metoda de izolare a Ostwald.
Creșterea concentrației „B“ și „C“ mai mult de 10 de ori. Procedura pentru aceste substanțe este zero, concentrația lor nu se va schimba. Se determină „n1“ este una dintre acele metode care au fost discutate mai sus. Așa cum am proceda, determinarea ordinii de reacție a substanțelor B și C, adică N2 și N3.