legătură covalentă
Metoda de legături de valență sunt următoarele:
1. Legătura covalentă este formată de doi electroni cu spin opus, în care perechea de electroni aparține doi atomi.
2. Legătura covalentă este mai puternică, cu atât mai mult se suprapun norii de electroni.
Legătură covalentă - tipul legăturii chimice. implementat prin formarea unei perechi de electroni, care aparține ambii atomi. Desemnat ca „:“ sau „-“.
Pe mecanismul de formare a unei legături covalente este împărțită în:
- legătură covalentă schimb;
- donor-acceptor legătură covalentă.
legătură covalentă schimb are loc între atomii de carbon. În cazul în care fiecare atom dă un electron nepereche în perechea de electroni totală.
Donor-acceptor este o legătură covalentă care un atom (donor) dă o pereche de electroni, iar celălalt atom (acceptor) prevede această pereche de liberă orbital.
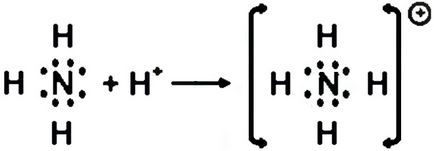
În plus față de simple legături, pot forma legături duble și triple covalente.
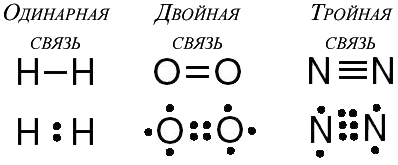
Proprietățile legăturii covalente.
- saturație;
- orientare;
- polarizabilitatea.
Saturation - capacitatea de a forma strict anumită cantitate de legături covalente (1 la 6), care determină elementul maxim posibil valenței.
Direcționalitate - atomii de aspirație, pentru a forma cea mai mare densitate de electroni între nucleele.
Polarizabilitatea - deplasarea electronilor sub influența unui câmp electric extern.
- legătură covalentă nepolară, care este nor de electroni format prin comun perechea de electroni distribuite în spațiu simetric în raport cu nucleele celor doi atomi (exemple: Cl2, N2).
- legătură covalentă polară adică norul total de electroni smesh spre unul dintre atomii, astfel că există o asimetrie în distribuția de încărcare (exemple: CO, H2O).
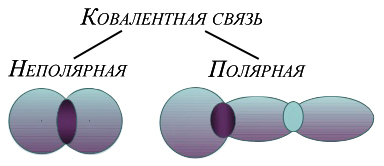
Electronegativitate - este abilitatea de a întârzia atomii la sine pereche de electroni totală.