acțiunea chimică a curentului electric - studopediya
Soluțiile sărurilor și acizii în apă sau orice alt comportament solvent curent electric și se numesc electroliți sau conductorilor de al doilea tip, în contrast cu conductori metalici, conductorii primului tip menționat.
Curentul electric poate trece printr-un mediu având electric
particulele încărcate care au capacitatea de a muta.
Când săruri dizolvate și de acid în apă sau în orice alt solvent (. Alcool etilic, benzină, benzen, etc.) din molecule împărțit în două părți, numite ioni, în care o parte are o sarcină pozitivă, iar cealaltă - sarcina negativă.
Dacă într-un vas cu două plăci de metal cu electrolit livrate numite electrozi, care prin fir duce conectat la
sursa de curent continuu, din cauza diferenței de potențial dintre electrozi prin electrolit la fluxul de curent.
Trecerea curentului prin electrolit însoțită de un proces chimic numit electroliza. Situat în electroliți sunt atrase de electrozi, se deplasează în direcții opuse, ionii pozitivi - catod, în timp ce ionii negativi - anod.
Se apropie de catod, ionii pozitivi sunt produse din ea electronii care lipsesc și formează atomi neutri electric. La anod procesul invers are loc: ionii de anod negativ da electronii în exces.
Cu trecerea curentului electric prin electrolit la electrozi este alocată o anumită cantitate de substanțe conținute într-un compus chimic în electrolit.
Dependența materialului selectat pe un set de curent
Faraday două legi.
Prima lege a lui Faraday formulat după cum urmează: cantitatea de materie a evoluat la electrozi atunci când curentul trece prin electrolit este direct proporțională cu cantitatea de energie electrică a trecut prin electrolit.
Cu trecerea pandantiv de electricitate din electrolit este alocată o anumită cantitate din masa unei substanțe care se numește echivalentul electrochimic al substanței.
În calculele practice pentru a determina cantitatea de energie electrică nu este convenabil de a folosi pandantive, și amperi-oră (Ah).
Deoarece un pandantiv egale amperi-secunde, între ampere-oră și pandantiv următoarea relație are: 1 Ah = 3600 A = 3600-c Cl.
Un echivalent electrochimic al K este exprimată în grame, atribuită aceeași cantitate de energie electrică ampere-oră (g / A * h) T. E. Masa cantitatea de material eliberat din electrolit și exprimată în grame, în timp ce trece prin electrolit este una amper oră Cantitatea de energie electrică .
A doua lege a lui Faraday prevede că: atunci când aceeași cantitate de energie electrică care curge prin diferitele electroliților, un număr de masă de substanțe precipitate pe electrozi, sunt proporționale cu echivalenții lor chimici.
Dintr-o comparație între 1 și 2 nd legea lui Faraday implică faptul că echivalentele electrochimice sunt proporționale cu compuși chimici echivalenți lor, t. E.
K1 / K2 = a1 / a2 = K3 / a3 =.
Prin urmare, raportul dintre echivalenții electrochimice la echivalenții lor chimici este constantă și egală cu
R / a = 3,72 / 0,0372 = 100;
Astfel, legea a doua a lui Faraday poate fi exprimată după cum urmează.
K și x = 0,0372;
Electroliza a fost utilizat pe scară largă în diferite industrii: În electroformarea, galvanizare, pentru curățarea (rafinare) și alte metale.
celule galvanice
Conductoarele de primul tip (solid) și al doilea tip (electroliti lichizi) sunt utilizate împreună în elementele galvanice care deservesc surse de curent continuu.
In celulele galvanice în timpul funcționării lor există o mișcare a ionilor și depunerea pe electrozii elementului, emise de materialul electrolit.
Cel mai simplu element este galvanizată de cupru-zinc.
Într-un vas de sticlă umplut cu o soluție de acid sulfuric în apă, cufundat plăci de cupru și zinc, care sunt polii pozitivi și negativi ale elementului.
Când circuitul elementului de închidere în orice conductor din interiorul acestui element va trece curent de placa negativă zinc la cupru pozitiv, iar circuitul exterior de cupru la zinc.
Sub influența curentului în interiorul celulei ioni de hidrogen pozitiv se deplaseze de-a lungul direcției curentului, restul de acid ioni negativi - în direcția opusă.
Contactul cu o placă de cupru, ioni pozitivi de hidrogen dau tarifele lor, și bule de gaz de hidrogen se acumulează la suprafața sa.
În același timp, ionii negativi din restul de acid sulfuric da farfurie taxele de zinc. Astfel, există un element continuu placă de încărcare care acceptă diferența de potențial (tensiune) la bornele sale.
Izolarea hidrogenului pe elementul placa de cupru slăbește său de acțiune - elementul polarizator.
Fenomenul de polarizare este că se acumulează pe electrodul pozitiv generează hidrogen în combinație cu diferența de potențial de electrod metalic suplimentar se numește polarizare forță electromotoare. Această forță electromotoare este îndreptată opus celulei forță electromotoare.
In plus, bulele de hidrogen care acoperă o parte din placa de cupru, reduce suprafața care acționează, iar acest lucru crește rezistența internă a celulei.
Polarizarea în luarea în considerare a elementelor este atât de mare, ceea ce îl face nepotrivit pentru scopuri practice.
Pentru eliminarea fenomenului de polarizare a unui absorbant este introdus în elementul (depolarizer), care este proiectat pentru a absorbi elementul hidrogen și acumularea acestuia nedopuskaet la polul pozitiv.
Depolarizers pot fi substanțe chimice, oxigen bogate sau clor.
Forța electromotoare a unui element de cupru-zinc este 1.1V, iar rezistența internă ca funcție de timpul de funcționare - 5.10 Ohm.
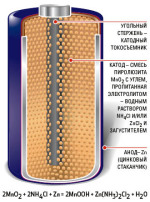
Celulele carbon-zinc placa pozitivă pol este cărbunele,
și negativ - tijă zinc.
Depolarizer în acest element este presat sub un amestec de înaltă presiune numit aglomeratului. Se compune dintr-un peroxid de mangan și grafit.
Electrolitul din celula de carbon de zinc se utilizează o soluție apoasă de clorură de amoniu.
Forța electromotoare a celulei de zinc-carbon 1,4-1,5 La descărcare rapidă la o valoare medie de 0,9-1,1 V, iar rezistența internă ca funcție a elementului structural - ohmi 0,25-0,7 la începutul descărcării și 1.4-5 ohm la sfârșitul anului.
Elemente de zinc-carbon produce industria internă ca așa-numita celulă uscată a tipurilor de cupă și galetnogo foarte convenabil pentru a transporta și de transport.
In elementele uscate pol pozitiv de tip cupă este plasat în interiorul aglomeratului cu cutie de zinc. care servește ca element negativ pol.
Spațiul dintre pereții aglomeratului cutie și zinc umplut cu o pastă formată din clorură de amoniu și soluție făină de cartofi.
Deasupra aglomeratul stivuite căptușeală de carton. care nasyplyut strat de rumeguș; top garnitura capac de praf.
Apoi se toarnă elementul de rășină, în care este introdus un tub. Scopul tubului - pentru a îndepărta gazele formate în interiorul elementului.
La ieșirea din rășina electrod carbon nasazhivajut capac de cupru
Șuruburi și piulițe pentru conectarea conductorului.
La partea de sus a cutiei de zinc (polul negativ) este sudat conductor flexibil izolat. Pe fundul cutiei este plasată o căptușeală izolatoare.
Celula wafer este o placă de zinc negativ electrod pozitiv - compactate sub formă de pulbere crackers dioxid de mangan cu carbon.
Suprafața exterioară a plăcii de zinc este acoperită cu un strat de grafit de particule pe bază de colofoniu pentru conductivitate.
Clorura de vinil este folosit ca pelicula de izolare.
Elementele de vafele sunt compacte și materialele active ale acestora (în special zinc) este utilizat mai bine decât în elementul cupa.
Dispozitiv de baterie este numit, are capacitatea de a acumula si persista de ceva timp, energie electrică prin procese chimice.
Bateria, la fel ca în celula electroformarea, un curent electric este o consecință a proceselor chimice.
Dar, spre deosebire de bateria în celula care rezultă compuși chimici care nu pot fi descompuse din nou și adus în starea inițială a unui curent de sursă externă.
Prin urmare, celulele galvanice sunt numite baterii primare și reîncărcabile - secundare sau reversibile.
încărcare repetată și descărcarea de gestiune nu este numai dăunătoare pentru baterie, dar chiar și a îmbunătăți proprietățile sale, deoarece toate lucrările implicate straturile profunde ale plăcilor de electrozi.
În funcție de compoziția bateriilor de electrolit pot fi acide și alcaline.
Acumulator acid mai simplu
Se compune din două plăci de plumb (electrozi) imersate în electrolit, care este apa, cu o ușoară adăugare de acid sulfuric.
Constant curent sursă externă, care trece prin electrolit se descompune în părțile sale componente.
In interior are loc mișcarea electrolitului ioni de hidrogen pozitiv H2 plãcuþa conectat la borna negativă a unei surse de curent și ioni de oxigen negativi O la o placă conectată la borna pozitivă a sursei de alimentare.
Ca rezultat al electrolizei este oxidat pe electrod pozitiv plumb și burete plumb este format pe electrodul negativ.
Dacă bateria este deconectată de la sursa de curent și aproape de unele receptor de energie, sursa de energie a bateriei în sine ar dori o celulă electrochimică în care electrozii sunt plăci care diferă una de cealaltă, în compoziția chimică.
baterii cu electrolit acid, așa cum este indicat mai sus, servește soluție acidă greutate specifică.
- Densitatea unei soluții este numărul care indică de câte ori masa acestei soluții este mai mare decât masa de apă din același volum.
- Când se prepară o soluție pentru baterie, acid sulfuric se toarnă într-un curent subțire în apă.
- Este imposibil să se toarnă apă în acid sulfuric, deoarece stropii rapidă se întâmplă de acid, ceea ce poate provoca arsuri.
- Apă pentru electrolit distilat.
- emf bateriei depinde de densitatea electrolitului și nu depinde de dimensiunea sa și capacitatea nominală.
- În procesul de încărcare a bateriei și densitatea de descărcare zlektrolita nu rămâne constantă, datorită acestor schimbări ca forță electromotoare și tensiunea la egozazhimah.
tensiune modificări de program
acid baterie:
1 - la un cost suplimentar,
2 - în timpul descărcării.
Cantitatea de energie electrică pe care bateria poate da la un anumit curent de descărcare la tensiunea cea mai mică permisă, numită capacitatea sa.
Acesta este egal cu produsul dintre curentul de descărcare în amperi la timpul durata descărcării în ore și se exprimă în amperi-oră.
Conectarea plăcilor de baterii acide diagrama.
Capacitatea bateriei depinde de cantitatea de compoziție activă, cantitatea de curent și de temperatură.
Sub capacitatea nominală de a înțelege cantitatea de energie electrică, care oferă o baterie complet încărcată la
Modul de descărcare de 10 ore și o temperatură de 25 ° C
Astfel, bateria trimite o capacitate nominală, descărcarea de 10 ore de șoc este numeric egal cu valoarea de 0,1 capacității sale nominale.
Prin creșterea curentului de descărcare, capacitatea bateriei scade, deoarece suprafața plăcilor acoperite cu electrolit sulfat de plumb și accesul dificil la straturile interioare ale masei active.
Pe măsură ce temperatura scade vâscozitatea crește electroliți, ceea ce face, de asemenea, dificil accesul la straturile interioare ale masei active și reduce capacitatea bateriei.
Pentru a crește capacitatea plăcilor bateriei de mai multe cum ar fi conectate în paralel.
Fiecare grup de plăci pozitive și negative funcționează ca o placă mare, a cărui suprafață este egală cu suma suprafețelor de plăci paralele conectate.
Deoarece plăcile pozitive trebuie să fie între negativ, numărul de plăci negative, întotdeauna unul mai mare decât numărul de pozitive.
În aceste condiții, ambele părți ale plăcilor pozitive vin în contact cu electrolitul (când plăcile pozitive sided urzeală și scurtcircuitul pot apărea la contactul cu plăci negative).
acid baterii staționare fabricate din sticlă sau vase de ceramică. Bateriile de containere mari au vase de lemn sau de material acid izolant-plumb căptușit.
Bateriile acide sunt utilizate în instalația electrică de tip staționar și cu mașina.
Ca bateriile portabile se folosesc baterii predominant alcaline.
baterii alcaline.
Navele sigilate baterie alcalină din tablă de oțel subțiri și nichel pe partea exterioară. În centrul capacului containerului are o deschidere pentru turnare baterii electrolit.
Eds baterie alcalină depinde de starea masei active a plăcilor. EMF Densitatea temperaturii și electrolit depinde ușor și numai la temperaturi joase, aproape de zero, se schimbă brusc.
Tensiunea la capătul bateriei este de 1,8 V, încărcarea este terminată - 1.5-1.55 V;
emf descărcat bateria - 1.3 V.
Avantajul baterii alcaline este că
- ei nu au nevoie de îngrijire medicală;
- nu se tem să se agită;
- poate fi lung în starea rarefiat;
- să ia un scurt-circuit, care pentru bateriile acide sunt foarte periculoase;
- auto-descărcare în baterie alcalină este mai mică decât cea a acidului.
În funcție de materialul bateriilor electrozi alcaline pot fi nichel-cadmiu, fier-nichel, argint-zinc, aur-zinc și gaz.
Utilizarea unei baterii de aur-zinc la scară mare este limitată de costul lor ridicat.
Bateriile de gaz sunt ușor și ieftin, dar tehnologia nu este suficient de dezvoltată producția lor.
Cele mai utilizate pe scară largă nichel-cadmiu (KH)
și nichel-fier (LS) baterii, care servește ca o soluție de electrolit de hidroxid de potasiu în apă; Densitatea electrolit 1.2.
Conform dispozitivului său de date și o baterie electrică și KH LS diferă ușor una de cealaltă.
Masa activă este presată în brichete (pachete), iar apoi au fost colectate brichete din plăci individuale.
În Tip baterie LS plăcile negative cu una mai mult decât pozitiv.
În KH baterie plăci pozitive de pe unul mai mult decât negativ.
Unul dintre polii bateriei este conectată la vasul (în FS - negativ,
în timp ce SC - polul pozitiv).
acumulator de argint-oxid este un recipient din plastic, în care sunt plasați electrozii pozitivi și negativi sunt compuse din plăci individuale.
Electrozi negativi fabricate din foi de oxid de zinc, închise într-un ambalaj de protecție dintr-un material care transmite bine electrolit dar reține particulele metalice.
Plăci pozitive sunt realizate din argint.
Pentru prepararea celulelor bateriei electrochimice sau baterii, mai multe elemente conectate în serie, adică. E.
catodul prima baterie este conectat la anodul al doilea,
al doilea catod - la anod al treilea și așa mai departe ..
obținându-se astfel electrozi liberi, și anume un anod și un catod al primului element ultima sunt, respectiv, polii pozitivi și negativi ai bateriei.
La determinarea forței electromotoare a bateriei bateriilor n-acizi sau celule electrochimice cu un singur element emf Eo și rezistența internă Ro = E emf bateriei Ne0 și rezistența R internă = nR0.