structura cristalină
CAPITOLUL I. STRUCTURA ȘI PROPRIETĂȚI DE METALE
§ 1. Structura cristalină
Tipuri de barilor de cristal. Substanțele solide sunt împărțite în cristalină și amorfă. corpul cristalin în timpul încălzirii rămân solide până la o anumită temperatură (temperatura de topire) la care trec la starea lichidă. corp amorfa înmuiate prin încălzire într-un interval mare de temperatură; În primul rând ele devin vâscoase și abia apoi se lichefieze.
Toate metalele și aliajele lor - solide cristaline. Fier numite elemente chimice care sunt trăsăturile caracteristice ale opacității, luciul, conductivitatea electrică și termică bună, ductilitate și pentru multe metale capacitatea de a fi sudate. Ea nu și-a pierdut determinarea valoarea sa științifică a metalelor, în urmă acest peste 200 de ani de marele om de știință român M. V. Lomonosovym: „Metalele sunt lumina corpului care poate falsifica.“ Pentru metale, caracterizată prin faptul că, prin introducerea într-o reacție chimică cu elementele care sunt nemetale, acestea dau din urmă electronii exterioare, valență. Acest lucru se datorează faptului că atomii de metal legat vag electronii exteriori din miezul ei. Metalele sunt pe învelișul exterior doar 1-2 electroni, în timp ce mulți nemetale astfel electroni (5-8).
Elemente chimice pure ale metalelor (de exemplu, fier, cupru, aluminiu, etc.), se poate forma o substanță complexă a cărei compoziție poate cuprinde mai multe elemente metalice, de multe ori cu elemente de impurități, cantități apreciabile de nemetale. Astfel de substanțe sunt denumite aliaje metalice. Substanțe simple care formează aliajul numit componente din aliaj.
Pentru a descrie structura cristalină a metalelor utilizează zăbrele concept. Rețeaua cristalină - o rețea spațială imaginar, nodurile care sunt localizate atomi (ioni) ce constituie metalul. Particulele de substanță (ioni, atomi) din care este construit de cristal, aranjate într-un model geometric bine definit, care se repetă periodic în spațiu. Spre deosebire de cristale în corpurile amorfe (sticlă, material plastic) atomii sunt aranjate în spațiu aleatoriu, în mod aleatoriu.
Formarea rețelei cristaline în metal, după cum urmează. Când metalul trece de la lichid la stare solidă, distanța dintre atomii este redusă și forța interacțiunii dintre ele crește. Interacțiuni Caracter atomi determinate de structura cochiliile electronice exterioare. Când se apropie de atomi de electroni localizate pe membranele exterioare, își pierd contactul cu atomii lor datorită separării electronilor de valență al unui atom încărcat pozitiv nucleu de altul și așa mai departe. E. Formarea de electroni liberi, pentru că ei nu aparțin unui singur atom. Astfel, în metalul în stare solidă este o structură formată din ioni încărcați pozitiv, electroni liberi spălate.
Comunicarea în metalul se realizează prin forțe electrostatice. Între ionii și electronii liberi apar forțe de atracție electrostatice care strâng ioni. O astfel de conexiune între particulele de metal numite metal.
Forțele de legare a metalelor sunt determinate de forțele forțelor repulsive și atractive între ioni și electroni. Ionii sunt situate la o distanță una de alta, în care energia potențială de interacțiune este minimă. Ionii metalici sunt aranjate într-o anumită ordine pentru a forma un grilaj. Acest aranjament este furnizat prin interacțiunea ionilor cu electroni de valență care leagă ionii în rețeaua cristalină.
Tipuri de Grile cristaline in diferite metale diferite. Cea mai frecventă zăbrele: a cubică cu volum (bcc), fata centrata cubic (fcc) și hexagonale ambalate aproape (HCP). Cea mai mică cantitate de cristal, oferind o idee despre structura atomică a metalului în oricare din volumul său, numită celulă cristalină elementară (Fig. 1). Acesta este caracterizat prin parametrii de cristal cu zăbrele, cum ar fi lungimea marginilor de cub pentru bcc și fcc, ceea ce face pentru diferite metale -8 2.8610 cm.
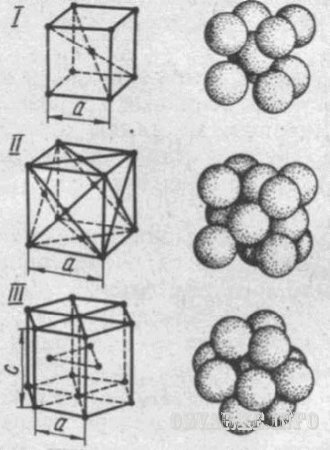
Fig.1. Celulele unitare ale barilor de cristal:
I - centrată pe volum cubic (-Fier), II - un Cubic cu fețe centrate (cupru); III - hep; și și - parametrii latici
Defecte în cristale. În cristalele, există întotdeauna defecte (imperfecțiuni) structura, cauzată de dereglarea poziționarea corectă a rețelei cristaline a atomilor. Defecte în structura cristalină sunt împărțite în funcție de caracteristicile geometrice pe un punct, linie și suprafață.
Atomii oscila în apropierea punctelor de zăbrele, iar temperatura crește amplitudinea acestor vibrații crește. Majoritatea atomilor rețelei cristaline au aceeași (medie) intervalul de energie și pentru o temperatură dată, cu aceeași amplitudine. Cu toate acestea, atomii individuali au energii de energie medie considerabil mai mari si sa mutat dintr-un loc în altul. Cel mai ușor de a muta atomii stratului de suprafață, lăsând la suprafață. Un loc unde a existat un astfel de atom se numește vacant (Fig. 2a). In acest loc, după un timp se deplasează unul dintre atomii din stratul adiacent și așa mai departe. E. poziția deschis, astfel, se deplasează în interiorul cristalului. Cu creșterea temperaturii, numărul de posturi vacante este în creștere și acestea sunt mai susceptibile de a trece de la un nod la altul. Procesele de difuzie din metale, locuri de muncă joacă un rol decisiv. Pentru defectele punctuale sunt, de asemenea, un atom, o latice interstițiale (Fig. 2b), și un atom substituit când locul unuia dintre atomul de metal din rețeaua este înlocuită cu o alta, un atom străin. defectelor punctuale cauza distorsiuni locale a rețelei cristaline.
defecte liniare sunt vederi ale altor imperfecțiuni esențiale ale rețelei cristaline, ca rezultat al forfecare pe o distanță interatomică a unei părți din zăbrele în raport cu celălalt de-a lungul unui număr plan de rânduri de atomi într-un grilaj pe partea superioară a unuia mai mare decât partea de jos. În acest caz, ar fi ca in plus plan atomic la partea de sus a grilajului (a suplimentare). Marginea extra perpendicular pe direcția de alunecare, se numește o muchie sau dislocare liniară (fig. 2c), a cărei lungime poate ajunge la mai multe mii de distante interatomice. implementare Wide este distanța de la centrul de la locul defectului cu zăbrele, fără distorsiuni. Lățimea dislocare este mică și se ridică la câteva distanțe atomice.
Crystal dislocații zăbrele în zona deformată elastic, deoarece atomii din această zonă sunt deplasate în raport cu starea lor de echilibru. Pentru luxații caracterizate prin mobilitatea lor ușoară. Acest lucru se datorează faptului că atomii care formează dislocare tinde să se miște într-o stare de echilibru. Dislocările sunt formate în timpul cristalizării metalelor (vezi. Cap. 1, § 2), precum și deformare plastică, tratament termic și alte procese.
defecte superficiale sunt interfețe între cristale individuale (Fig. 2d). La interfața dintre atomii cristalului sunt mai puțin bine decât în cea mai mare parte. În plus, interfețele acumulează dislocațiilor și posturi vacante, precum și impuritățile concentrate, care încalcă în continuare ordinea dispunerea atomilor. Mai mult decât atât, aceste cristale sunt orientate greșit, t. E. Poate fi rotit în raport cu celălalt prin zeci de grade. rezistența metalului poate crește din cauza o denaturare a rețelei cristaline în apropierea limitelor sau scăderii datorită prezenței impurităților și a concentrației defect. Defectele din cristalele afectează semnificativ proprietățile de metal.
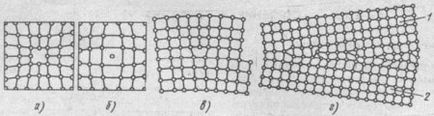
Fig. 2. Defecte în cristale:
și - poziție deschisă, b - Un atom plantat în - liniar muchie dislocare g - atomi misplacement nna limita granulei 1 și 2
cristale anizotropie. Dissimilarity proprietăților fizice ale mediului în diferite direcții se numește anizotropie. Anizotropiei cristalului cauzată de diferența de ambalare densitatea atomilor în rețeaua în direcții diferite. Toate cristalele sunt anizotrope și substanțele amorfe (sticlă, rășină) sunt izotrope, adică. E. Au aceeași densitate atom în direcții diferite.
Anizotropiei proprietăților este importantă atunci când se utilizează cristale unice - particule unice de cristal, care sunt situate în mod uniform pe întreg volumul lor. monocristale au un aspect de cristal obișnuit (sub formă de poliedre naturale) sunt anizotrope în proprietăți fizice mecanice, electrice și altele. Astfel, pentru un singur cristal de cupru rezistență la tracțiune # 963; in este schimbat 120-360 MPa, în funcție de direcția de aplicare a sarcinii.
Metale și aliaje utilizate în domeniu, în general, au o structură policristalină. t. e. constau dintr-o multitudine de cristale mici și orientate în mod diferit, nu are o tăietură de cristal regulate și numite cristalite (sau granule). Fiecare policristalină cereale observate anizotropie. Cu toate acestea, din cauza diferite, orientare cristalografică aleatorie avioane boabe policristalină diferite pot avea aceleași proprietăți în direcții diferite și să nu detecteze anizotropie (atunci când dimensiunea granulelor este mult mai mică decât dimensiunea policristalină și numărul lor este foarte mare). Această circumstanță, în multe cazuri, poate fi considerat cum ar fi un organism izotropă policristalin în ciuda proprietăților anizotropia boabe componente individuale.
Câștigați pe cunoștințele lor. Răspundeți la întrebările și plătit pentru asta!