model de atom
experiență Rutherford
Experiența Rutherford. Un fascicul de particule alfa încărcate pozitiv emise de elemente radioactive, îndreptate spre ultrathin folie de aur de aproximativ 400 nm grosime de. Particulele au trecut prin folia, înregistrată pe ecran cu ajutorul unui microscop.
Numeroase experimente au demonstrat că, dar-particule foarte rare sunt deviate un unghi semnificativ (90 0 și 180 0). Așa cum a scris Ernest Rutherford (1871-1937). „A fost aproape la fel de improbabil ca și în cazul în care ați împușcat într-o foaie de hârtie absorbantă coajă de 15 inch, și sa întors în spate și a intrat în tine.“
Ce ar putea însemna? Faptul că există un câmp electric foarte puternic în interiorul atomului, care este creat sarcină pozitivă, concentrată într-un volum foarte mic. Numele de „miez“ a fost sugerat de Rutherford. Kernel-ul, de asemenea, concentrat întreaga masă a atomului.
Modelul nuclear al atomului
In 1911, Ernest Rutherford a propus modelul nuclear al atomului.
Conform acestui model, în centrul atomului este încărcat pozitiv nucleu, care se concentrează aproape întreaga masă a atomului (99,96%). Diametrul miezului nu depășește 10 -14 -. 10 -15 m Atom în general neutru. În jurul miezului de orbite închise se rotesc sub acțiunea forțelor Coulomb de atragere a electronilor de nucleu. Într-o stare de repaus nu exista electroni mogut.Zaryad de bază trebuie să fie egală cu sarcina totală a electronilor aparținând atomului. Aceasta este, q = + Ze = -Ze. în cazul în care Z - numărul de ordine al elementului din tabelul periodic. e - taxa elementară.
postulate ale lui Bohr cuantice
Modelul nuclear al atomului nu a putut explica următoarea contradicție: pe orbită, el trebuie să radieze unde electromagnetice, atunci când se deplasează de electroni. Prin urmare, pierde energie și 10 -13 să înceteze să mai existe. Spectrul unei emisii atom trebuie să fie continuă, mai degrabă decât un spectru linie.
Niels Hendrik David Bohr (1885 - 1962) în 1913 a propus un model cuantic al atomului bazat pe următoarele postulatelor mint.
Am postulat Bohr (stările staționare postulat). electron din atomul poate fi prezent numai în stări speciale (cuantice), fiecare dintre care corespunde unei anumite energie. Atunci când electronul este într-o stare de echilibru, revolving în orbita sa, nu radieze.
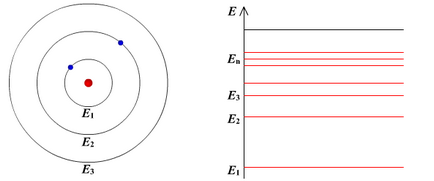
în stare de staționare pot fi numerotate, iar fiecare stat are propria energie fixă.
II Bohr postulăm (frecvențe de obicei). atom la trecerea de la o stare de echilibru la un alt foton emise sau absorbite de radiații electromagnetice, a căror energie este egală cu diferența de energie dintre stările de electroni ale datelor.
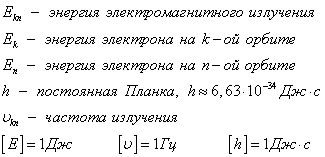
În cazul în care CE> En. radiații de energie care are loc în cazul în care CE <Еn - ее поглощение.
Stat al atomului, care corespunde celui mai redus de energie se numește sol. un stat cu mai multă energie - excitat. În starea solului, electronul poate rămâne pe termen nelimitat, dar și în alte state nu mai mult de 10 -8 s.
II Bohr postulăm posibil pentru a explica structura liniilor spectrelor atomice.
III Bohr postulăm (orbite regula cuantizare). orbite de electroni staționare se găsesc din starea
