Legătură covalentă - polare și nepolare, mecanismele de formare
Legătură covalentă (de la cuvântul latin „cu“ împreună și «Văi» având forță) se realizează printr-o pereche de electroni aparținând ambii atomi. Formată între atomii nemetalelor.
nemetale electronegativitate destul de mare, astfel încât interacțiunea chimică dintre doi atomi de nemetale transferul complet de electroni de la unul la altul (ca și în cazul legăturii ionice) este imposibilă. În acest caz, pentru a îndeplini regula este necesară pentru a octetului uni electroni.
Ca un exemplu, ia în considerare interacțiunea dintre atomi de hidrogen și clor:
1 1s H - un electron
1s Cl 2s 2 2 2 2p 6 3s 3p 5 - șapte electroni extern
Fiecare dintre cei doi atomi îi lipsește un electron pentru a avea un înveliș complet electron exterior. Și fiecare atom de presă „în uz comun“, un electron. Astfel, regula octetului este îndeplinită. Cel mai bun din toate IMAGE-recoltare este folosind formule Lewis:
formarea legăturii covalente
împerecheat electroni aparțin acum ambii atomi. atom de hidrogen are doi electroni (propriu și socializat lor de electroni atomului de clor), un atom de clor - opt electroni (plus atom de hidrogen de electroni socializate). Acești doi împerecheat electroni formează o legătură covalentă între atomii de hidrogen și clorit-ra. Rezultând din legarea a doi atomi se numește o moleculă de particule.
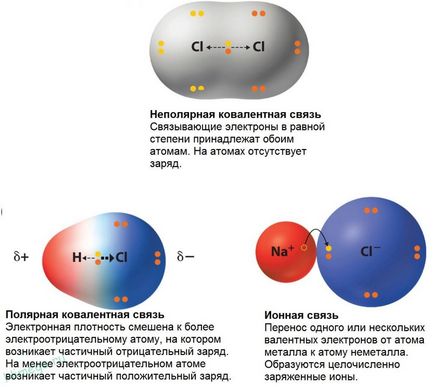
legătură covalentă nepolari
Legătura covalentă poate fi formată între două E-atomi identici. De exemplu:
Covalentă conexiune nepolar
Această schemă explică de ce hidrogen și clor există sub formă de molecule diatomice. Multumesc pereche, și socializarea celor două elec-trons Pot Octetul regulă pentru cei doi atomi.
În plus față de legături simple pot forma dublă sau triplă legătură covalentă, cum ar fi moleculele de oxigen O2 sau N2 azot. Atomii de azot au cinci electroni de valență, deci pentru mantaua de finalizare necesită trei mai electro-on. Acest lucru se realizează prin socializare trei perechi de electroni după cum este ilustrat mai jos:
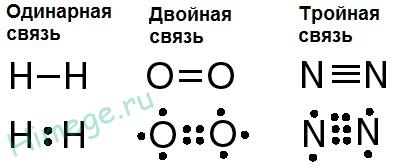
Compuși covalente - de obicei, gaze, lichide, sau comparative, dar solide de topire scăzut. Una dintre puținele excepții sunt etsya diamant, care se topește peste 3500 ° C, Acest lucru se datorează structurii de diamant, care reprezintă o rețea continuă de atomi de carbon legați covalent, și nici o pluralitate de molecule individuale. Inst-Cally orice diamant de cristal, indiferent de dimensiunea sa, reprezintă o singură moleculă uriașă.
Cuplarea covalentă are loc atunci când combinarea a doi atomi de electroni metaloid. Structura rezultată este menționată în această moleculă.
legătură covalentă Polar
În cele mai multe cazuri, doi atomi legați covalent au electronegativitate timp ing și electroni partajate nu aparțin doi atomi sunt la fel. Cele mai multe ori acestea sunt locat-dyatsya mai aproape de un atom decât celălalt. Molecula de acid clorhidric, de exemplu, electroni, formând o legătură covalentă sunt situate mai aproape de atomul de clor, ca electronegativitate său mai mare decât cea a hidrogenului. Cu toate acestea, diferența în capacitatea de a atrage electroni nu este atât de mare încât a existat un transfer complet al unui electron din atom de tipul atomului de apă de clor. Prin urmare, relația dintre atomii de hidrogen și clor pot fi considerate ca fiind undeva între o legătură ionică (transferul complet de electroni) și o legătură covalentă nepolară (Hex simetrice pereche aranjament de electroni între doi atomi de carbon). Debitare parțială-ny pe atomii notate cu litera grecească delta. O astfel de conexiune este numită o legătură covalentă polară și despre Molek les clorură spune că este polar, adică. E. Are un capăt încărcat pozitiv (atom de hidrogen) și un capăt încărcat negativ (atom de clor).
Tabelul de mai jos prezintă principalele tipuri de conexiuni și exemple de substanțe:

Mecanismul de schimb și donor-acceptor de formarea legăturii covalente
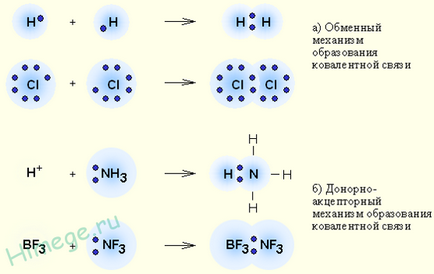
1) Mecanismul de schimb. Fiecare atom dă un electron nepereche în perechea de electroni de ansamblu.
2) Mecanismul Donor-acceptor. Un atom (donor) oferă o pereche de electroni, iar celălalt atom (acceptor) prevede această pereche de liberă orbital.