Legătura chimică 2
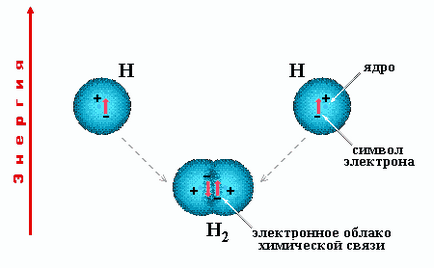
Fig. 2.1. Formarea moleculelor din atomii însoțite de redistribuire a electronilor din orbitalii de valență și conduce la un câștig de energie, deoarece energia moleculelor este mai mică decât energia atomilor neinteractionabile. Figura prezintă o schemă a legăturii chimice covalente nepolare între atomii de hidrogen.
În condiții normale, starea molecular stabil decât atomic (Fig.2.1) molecule .Obrazovanie de atomi însoțite de redistribuire a electronilor din orbitalii de valență și conduce la un câștig în energie, deoarece energia moleculelor este mai mică decât energia atomilor neinteractionabile (anexa 3). Forțele care dețin atomii din molecule, obținute conexiune nazvaniehimicheskoy generalizată.
Legătura chimică dintre atomii se realizează și electronii de valență este electrică în natură. Aici sunt patru tipuri de bază de legături chimice: covalente, ionice, ivodorodnuyu metal.
1 legătură covalentă
legare chimică, realizată de perechi de electroni se numește atomică sau kovalentnoy.Soedineniya cu legături covalente sunt numite atomic sau covalente.
În cazul unei legături covalente apare însoțită de eliberarea de energie care se suprapun nori de electroni ai atomilor care interacționează (Fig.2.1). Astfel, între nucleele atomice încărcate pozitiv dintr-un nor de mare densitate de sarcină negativă. Datorită acțiunii forțelor Coulomb de atracție între sarcini opuse crește densitatea de sarcină negativă favorizează nuclee de convergență.
Legătura covalentă este format de electroni nepereche ale carcaselor exterioare ale atomilor. Electronii cu spin opus obrazuyutelektronnuyu pereche (fig.2.2) comun atomilor care interacționează. Dacă ar fi existat unul dintre atomii de legătură covalentă (o pereche de electroni comun), aceasta se numește o simplă, dublă, etc. dve-
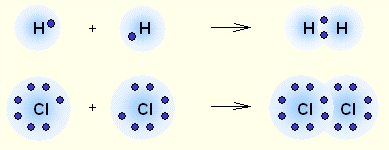
Fig. 2.2. Legătură covalentă - cea mai comună formă de legături chimice care are loc pereche de electroni prin socializare datorită mecanismului de schimb (a). când fiecare dintre atomii care interactioneaza livrează un electron sau prin intermediul unui mecanism donor-acceptor (b). electroni pereche atunci când sunt transmise la utilizarea în comun a unui atom (donor) la un alt atom (acceptor).
Covalentă are inapravlennosti svoystvaminasyschaemosti. Sub saturability legătură covalentă se referă la capacitatea atomilor cu vecinii lor formează un număr limitat de conexiuni determinate de numărul de electroni de valență all-nepereche. Regizat legături covalente reflectă faptul că forțele care dețin atomii unul lângă celălalt, sunt orientate de-a lungul liniei care unește nuclee. Mai mult decât atât, legătura covalentă poate fi polar sau nepolar.
În cazul unui nor de electroni legătură covalentă nepolară format prin comun perechea de electroni distribuite în spațiu simetric în raport cu nucleele celor doi atomi. Legătura covalentă nepolară se formează între atomii de substanțe simple, de exemplu, între aceiași atomi de gaz care formează molecule diatomice (O2. H2. N2, Cl2, etc.).
În cazul norului de comunicații electronice polare legături covalente mutat la unul dintre atomii. Formarea de legături covalente polare între atomii caracteristice substanțelor complexe. Un exemplu este molecula de compuși anorganici volatili: HCI, H2O, NH3 și altele.
Gradul de deplasare a norului total de electroni la unul dintre atomii în timpul formării legăturii covalente (gradul de polaritate conexiunea) este determinată în principal de încărcătura și raza nucleelor atomice interactioneaza atomi.
Cea mai mare sarcina nucleului atomic, cu atât mai mult atrage norul de electroni. În același timp, cu cât raza atomului, cu atât mai puțin electronii exteriori se limitează doar în apropierea nucleului atomic. Efectul combinat al acestor doi factori, și se exprimă în capacitatea de atomi diferiți „întârziere“ de sine nor covalent de legătură care variază.
Capacitatea unui atom dintr-o moleculă pentru a atrage electroni numite electronegativitate. Astfel, electronegativitate caracterizează capacitatea unui atom la polarizarea legăturii covalente: atomul mai electronegativ, cu atât este deplasată la norul de electroni a unei legături covalente.
Pentru a cuantifica electronegativitate a propus o serie de metode. Sensul fizic mai clar este metoda propusă de chimistul american Robert S. Mulliken, care a definit electronegativitate atom ca jumatate din suma de afinitate și ionizare energiiEi sale energiiEe electroni:
Energia de ionizare a unui atom este energia pe care trebuie să fie cheltuite pentru a „smulge“ din ea electronul și îndepărtați-l la o distanță infinită. Energia de ionizare este determinată de fotoionizare sau prin atomi de bombardament de electroni accelerați într-un câmp electric. Aceasta este cea mai mică valoare a energiei fotonilor sau de electroni, care devine suficientă pentru a ioniza atomii și le numesc ionizatsiiEi energie. De obicei, această energie exprimată în electron volți (eV): 1 eV = 1,610 -19 J.
da cel mai ușor electronii exteriori atomii metalici. care conțin pe învelișul exterior al unui număr mic de electroni nepereche (1, 2 sau 3). Acești atomi au cea mai mică energie de ionizare. Astfel, valoarea energetică de ionizare poate fi o măsură de elemente „metalicitate“ mari sau mai mici: mai mică decât energia de ionizare a mai puternic trebuie să fie elementul vyrazhenymetallicheskiesvoystva.
În același subgrup al sistemului periodic al elementelor D.I.Mendele-eva cu creșterea numărului atomic al elementului din energia de ionizare este redusă (tabelul 2.1), care este asociat cu creșterea razei atomice (tabelul 1.2) și, prin urmare, comunicarea cu slăbirea electron extern cu nucleul. În elemente de aceeași perioadă, crește energia de ionizare cu creșterea numărului atomic. Acest lucru se datorează o scădere a razei atomice și creșterea în sarcina nucleară.
Energia Ee. care stă la libera aderare electron electron atom nazyvaetsyasrodstvom (exprimat și în eV). Izolarea (nu absorbție) aderare a energiei încărcat cu electroni unii atomi neutri se datorează faptului că cea mai stabilă în natură sunt umplute cu atomi de cochilii exterioare. Prin urmare, atomii în care aceste cochilii „bit nu este umplut“ (adică, nu este suficient pentru a umple 1, 2 sau 3 electroni), este energetic favorabil pentru a se atașa la electroni, devenind ioni încărcați negativ 1. Asemenea atomi includ, de exemplu, , atomi de halogen (Tabelul 2.1) - elemente de grup a șaptea (grup principal) ale sistemului periodic al lui Mendeleev. Afinitatea de electroni din atomii de metal, de obicei egal cu zero sau negativă, adică este nefavorabil energetic care unește de electroni suplimentari, energie suplimentară este necesară pentru a le menține în atomi. Electron afinitate atomi metaloid este întotdeauna pozitiv și este mai mare cu atât mai aproape de gazul nobil (inert) este un metaloid în sistemul periodic. Aceasta este un indicator al proprietăților usileniinemetallicheskih măsură ce ne apropiem de sfârșitul perioadei.
Din cele de mai sus, este clar că electronegativitatea (2.1) de atomi crește în direcția de la stânga la dreapta pentru elementele fiecărei perioade și descrește în direcția în jos pentru elementele aceluiași grup din tabelul periodic. Este ușor, cu toate acestea, să înțeleagă că pentru caracterizarea gradului de polaritate a unei legături covalente între atomii importanți nu este valoarea absolută a electronegativitate, iar raportul dintre electronegativities atomilor ce formează legătura. Prin urmare, în practică, să utilizeze valorile electronegativitate relative (Tabelul 2.1), luând ca litiu unitate electronegativitate.
Pentru a caracteriza polaritatea unei legături chimice covalente folosind diferența relativă în electronegativities de atomi. De obicei, legătura dintre atomii A și B este considerat a fi pur covalentă, dacă | A -B | 0.5.