la prezentarea amoniacului 1
Prezentarea pe „Amoniac 1. Compozitie Structura 3. Proprietățile fizice 2. Prepararea amoniacului într-un laborator din industrie 4. Proprietăți chimice 5. 6. încercare de aplicare.“ - Transcrierea:
1 1. Compoziția de amoniac. Structură 3. Proprietățile fizice 2. Prepararea amoniacului într-un laborator din industrie 4. Proprietăți chimice 5. 6. Aplicație de testare

2 1. Legătura chimică din molecula de amoniac: a) ion; B) covalentă polar; B) covalentă nepolară. 2. Cum se poate amoniacul obținut în laborator: a) prin sinteză directă din azot și hidrogen; B) descompunerea termică a sării de amoniu; B) reacția sărurilor de amoniu cu alcalii. 3. După cum se poate distinge de clorură de amoniu și clorură de sodiu: a) miros; B) prin acțiunea de nitrat de argint; B) prin acțiunea alcalină la încălzire. 4. Soluția apoasă de amoniac este reacționat: a) cu acid clorhidric; B) hidroxid de calciu; B) cu apă. 5. Amoniacul este capabil să oxideze la azot liber: A) fără catalizator; B) sub presiune ridicată; B) cu un catalizator. 6. Mecanismul formării unui ion (cation) de amoniu: A) un donor-acceptor; B) ion; B radical); 7. Reacția de NaOH Equation + NH4Cl = NaCl + NH3 + H2O corespondenŃa ionic scurt: A) NH H + = NH4 + b) NH4 + NH3 = + H + In) NH OH¯ = NH3 + H 2 O B B B A A B

3 Compoziție. Structura NH 3 N 1s21s2 2s22s2 2p32p3 + H N H H3H H N 1s11s1 + δ + δ + δ + δ + δ + δ-δ-δ H sau H H HN 107,3º covalente polare legături chimice cristaline latice moleculare
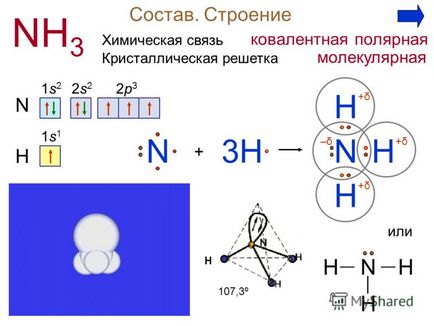
Prepararea 4 în amoniac amoniacul laborator slab preparat prin încălzirea unui amestec de hidroxid de calciu și sulfat de amoniu. Asigurați ecuația reacției pentru producerea de amoniac. Ca (OH) 2 + 2 (NH4) 2 SO 4 = CaSO 4 + 2NH 3 + 2H 2 O în amoniac industrial dă sinteza amestecului azotic de 200 atm, 400 ° C, Fe N 2 + 3H 2 2NH 3 sau Ca (OH) 2 + 2NH 4 Cl = CaCl2 + 2NH 3 + 2H 2 O experiență
6 Proprietăți fizice amoniac - gaz incolor, cu un miros caracteristic intepator, mai ușor decât aerul. Se determină densitatea amoniacului în aer. Odată cu creșterea presiunii ușoară sau sub răcire la - 33Sº lichefiază amoniac, devenind un lichid incolor mobil. Amoniacul este solubil în apă: la temperatura camerei 700 1obeme volume de amoniac solubil în apă, la temperatura de 0 ° C - 1200 volume. D Sports. (NH3) = M (aer) / M (NH3) = 29 g / mol / 17 g / mol = 1,7raz

7 Proprietățile chimice ale NH3 + H 2 O NH 3 · H 2 O NH OH - amoniac 1) Dizolvarea în apă este însoțită de o reacție chimică cu ea: N H + H + + H HH HH HHN + donor acceptor de cationi de amoniu 2) reacția amoniacului cu un acid : NH3 + HCl = NH4Cl Asigurați reacții ecuația de amoniac cu acid sulfuric (pentru a forma săruri secundare și acide), acid azotic. NH3 + H 2 SO 4 = (NH4) 2 SO 4, NH3 + H 2 SO 4 = NH 4 HSO 4 Mecanismul de formare a legăturii - donor-acceptor NH 3 + HNO3 = NH 4 NO 3 experiență
8 Reacția amoniacului cu acid clorhidric
9 Reacția amoniacului cu un acid
Brumărel 3) Oxidarea amoniacului (catalizator) 4NH 3 + 5O 2 = 4NO + 6H 2 O Reacțiile ca redox. Care sunt oxidanți, agenți de reducere. N -3 - 5e N O oxidare e 2O -2 04 mai reconstituire NH3 (datorită N -3) - agent reducător; Despre 2 - comburant.

Cu 4 noiembrie) Oxidarea amoniacului (fără catalizator) 4NH 3 + 3O 2 = 2N 2 + 6H 2 O Reacțiile ca redox. Care sunt oxidanți, agenți de reducere. N -3 - 5e N O oxidare e 2O -2 04 mai reconstituire NH3 (datorită N -3) - agent reducător; Despre 2 - comburant. 5) Amoniacul este capabil să reducă oxizii metalici inactivi NH3 + N 2 CuO + Cu + H2O Reacțiile ca redox. Care sunt oxidanți, agenți de reducere. Aranjați coeficienții. 2N -3 - 6e oxidarea N de Cu e Cu recuperare NH3 (datorită N -3) - agent reducător; CuO (în detrimentul Cu + 2) - comburant. 2NH 3 + 3SuO = N 2 + 3Cu + 3H 2 O experiență
12 amoniac de combustie în oxigen

13 iunie) metalele active pot înlocui un atom de hidrogen în amoniac. O bucată de sodiu în amoniac lichid este scăzută, se colorează culoarea mov, culoarea dispare cu timpul, iar după evaporarea amoniacului la fundul paharului rămâne albă amidură de sodiu pulbere: Luați în considerare răspunsul ca redox. Care sunt oxidanți, agenți de reducere. Aranjați coeficienții. NH 3 + Na NaNH2 + H2 2H e H Na 0 - 1e Na NH3 (datorită H + 1) - procesul de recuperare oxidant; Na 0 - proces de oxidare reducator. 2NH 3 + 2Na = 2NaNH 2 + H 2 sodamina
14 Experiența de laborator: Proprietăți Repeat săruri de amoniu reacție calitativă ion de amoniu. Se pune flaconul într-un amestec de clorură de amoniu și hidroxid de calciu și se încălzește amestecul. Se determină miros caracteristic care rezultă din amoniac și folosind hârtie indicatoare umedă.
1. Utilizarea de amoniac 15 Producerea de materiale plastice și fibre 2. în detergenți 4. În agricultură, medicină 4. 6. Prepararea Explozivii 5. Producerea acidului azotic 3. Producerea de îngrășăminte cu azot
17 1. Soluția apoasă de amoniac are: a) un mediu alcalin; B) un mediu acid; B) un mediu neutru; D) au un răspuns corect printre cele de mai sus. 2. Reacția amoniacului cu acid clorhidric, se referă la reacțiile. A) descompunere; ) compușii B; B) substituție; D) de schimb. 3. Amoniacul reacționează cu oxidul de cupru încălzit (II), restituindu-l cupru metalic. Atunci când amoniacul este oxidat la: a) fără azot; B) un oxid de azot (IV); B) un oxid de azot (II); D) de oxid nitric (V). 4. Nu este o reacție redox de amoniac cu: a) oxigen în absența unui catalizator; B) oxigen în prezența unui catalizator; C) de acid clorhidric; D) de cupru oxid (II). 5. Metodă de laborator pentru producerea de amoniac este: a) sinteza de azot și hidrogen; B) reacția cu clorură de amoniu alcalin; B) descompunerea termică de clorură de amoniu; D) toate răspunsurile de mai sus sunt corecte. 6. Scrieți ecuația reacției amoniacului cu acidul sulfuric, în rapoarte molare de 1: 1 și 2: 1. Cantități coeficienți din aceste reacții sunt A) 3 și 5; B) 3 și 4; B) 4 și 5; D) 5 și 6. A G A B B B