De celule - studopediya
celule galvanice - o sursă de curent chimic, în care energia eliberată în timpul curgerii electrozilor reacției redox este transformată direct în energie electrică.
Principiul de funcționare a celulei poate fi considerată prin exemplul Daniel elementului - Jacobi (Figura 9.2).
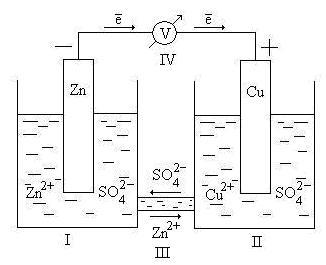
Fig. 9.2. Schema Daniel elementul galvanic - Jacobi
Aici I - pahar conținând soluție ZnSO4 în apă, cu o placă de zinc cufundat în aceasta; II - pahar conținând o soluție de CuSO4 în apă cu ea scufundat în placa de cupru; III - o punte de sare (element electrolitic) care asigură deplasarea cationi și anioni printre soluțiile; IV - un voltmetru (necesar pentru măsurarea forței electromotoare, ci o parte a celulei nu este inclus).
Potențialul de electrod standard al electrodului de zinc. Potențialul de electrod standard al electrodului de cupru. Din moment. atomii de zinc sunt oxidate:
Electrodul la care reacția de oxidare este, care trimite sau cationi într-un electrolit se numește anod. Având în vedere celulei electrochimice servește ca electrod anod zinc. Deoarece potențialul de electrod standard de zinc este mai mic decât cel al cuprului, electrodul de zinc este atribuită taxa condiționată „-“ și cupru - „+“.
Electronii eliberați prin oxidarea veniturilor din cupru (un curent electric) ale circuitului extern.
Pe electrodul de cupru este procesul de restaurare a electrolit Cu 2+ cationi:
Electrodul la care reacția de reducere este kotoryyprinimaet sau cationi din nazyvaetsyakatodom electrolit.
După cheia electrolitică este o mișcare a ionilor în soluție: SO4 2- anioni la anod, cationii Zn2 + la catod. Mișcarea ionilor în soluție completează circuitul electric al celulei electrochimice.
Reacțiile (a) și (b) sunt numite reacții de electrozi.
Combinând ecuațiile proceselor care au loc pe electrozi, ecuația totală se obține reacția redox care apar în celulă:
Zn + Cu 2+ = Zn 2+ + Cu