Cum de a determina reacția redox
În cazul interacțiunii dintre oxidare tipic și agenți de reducere, vă pot spune dintr-o privire că este o reacție redox. De exemplu, interacțiunea metalelor alcaline cu acizi sau halogeni, procesele de ardere cu oxigen.
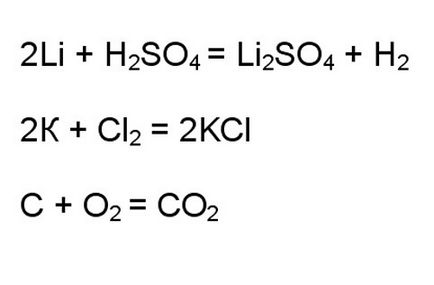
Să considerăm cazul mai complicate de exemplu reacția cu permanganat de potasiu, sulfit de potasiu, în prezența unor cantități mari de KOH alcalin. Pentru a vă asigura că reacția redox, determină gradul de oxidare a elementelor din partea dreaptă și partea stângă. Atomii unor elemente accepta întotdeauna sau să dea același număr de electroni. Această reacție este oxigen, hidrogen și potasiu. În altă stare de oxidare pot fi diferite, cum ar fi mangan și sulf.
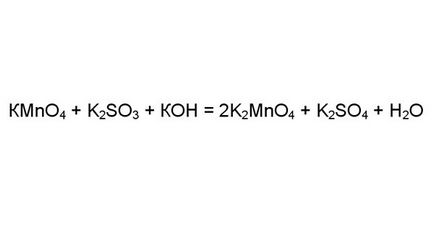
Se determină gradul de oxidare a manganului și a sulfului în partea stângă a ecuației. Ia permanganat de potasiu: oxigenul este întotdeauna acceptor de electroni în stare de oxidare (-2). Patru 8 electroni atașate atom de oxigen. Potasiul - donor de electroni și starea de oxidare (+1). Un atom de potasiu dă un electron. Apoi mangan trebuie sa dea: 8-1 = 7 electroni.
determinat în mod similar că gradul de oxidare sulf în sulfură de potasiu (4). Trei atomi de oxigen ia electroni 6 și doi atomi de potasiu donează doi electroni.
Acum găsi gradul de oxidare a acestor elemente de pe partea dreaptă. De manganat de potasiu K2MnO4 patru atomi de oxigen sunt atașate opt electroni și doi dau doi atomi de potasiu. Prin urmare, mangan a scăzut gradul de oxidare (7) până la (6), adică recuperate.
Sulf sulfat de potasiu, invers, oxidat la (4) la (6). Molecula K2SO4 atomii patru oxigen iau opt electroni, dar doi dat atom de potasiu doi. Prin urmare, șase electroni sunt luați la atomul de sulf.
Gradul de oxidare a manganului și sulfului schimbat. Și puteți trage concluzia că această reacție redox.
Reacția chimică - un proces de transformare a materialului care curge din modificarea structurii acestora. Aceste substanțe care reacționează, sunt numite sursa, iar cele care sunt formate prin acest proces - produse. Se întâmplă ca în timpul elementele de reacție chimică care intră în compoziția materiilor prime schimba starea lor de oxidare. Asta este, ei pot lua electronii altcuiva și să renunțe lor. Și, de fapt, și într-un alt caz, schimbarea taxa lor. Astfel de reacții sunt numite redox.

Notați ecuația exactă a reacției chimice pe care le au în vedere. A se vedea, elementele care sunt incluse în materiile prime, și ce gradul de oxidare a acestor elemente. Apoi compara aceste cifre cu grade de oxidare a acelorași elemente în partea dreaptă a reacției.
Dacă numărul de oxidare sa schimbat, această reacție este un redox. În cazul în care gradul de oxidare a elementelor rămân aceleași - nr.
De exemplu, un larg cunoscut de detectare calitativă reacția sulfatului ionilor SO4 ^ 2-. Esența ei este că sarea de sulfat de bariu, care are formula BaSO 4, practic insolubil în apă. La formarea cade instantaneu sub forma unui precipitat alb dens greu. Înregistrează orice reacție similară ecuație, de exemplu, BaCl2 + Na2SO4 = BaSO4 + 2NaCI.
Deci, din reacția vedeți că, în plus față de precipitatul de sulfat de bariu format de clorură de sodiu. Este o reacție redox? Nu există, din moment ce nici un element care apare în materialele de pornire nu și-a schimbat starea de oxidare. Și partea stângă și partea dreaptă a ecuației chimice starea de oxidare +2 bariu, -1 clor, sodiu +1, +6 sulf, oxigen -2.
Dar reacția Zn + 2HCl = ZnCl2 + H2. Fie că este un redox? Elemente de materii prime: Zinc (Zn), hidrogen (H) și clor (Cl). Vezi ce gradul lor de oxidare? Y zinc este 0 ca în orice substanță simplă de hidrogen +1, clor -1 y. Care sunt stările de oxidare ale acestor elemente în partea dreaptă a reacției? Clorul rămâne neschimbată, adică egală cu -1. Dar, la zincul a devenit egal cu 2 și hidrogen la - 0 (deoarece hidrogenul este izolat ca o simplă substanță - gaz). De aceea, această reacție este un redox.
Reacțiile redox sunt esențiale pentru organismul uman. Fără ei este procesele metabolice și de respirație imposibile. Cele mai multe reacții chimice în natură și producția industrială sunt redox.

Înainte de a defini reacții redox, este necesar să se introducă unele concepte. Primul dintre acestea - gradul de oxidare. Această taxă condiționată posedat de fiecare atom de substanță. În oxidarea însumare a tuturor atomilor trebuie să ajungă la zero. Astfel, este posibil să se găsească gradul de oxidare al oricărui atom care poate lua valori diferite.
Oxidarea - un proces de atom electroni de recul și recuperare - adăugarea de electroni. Oxidantul este orice substanță care este capabilă să accepte electroni (restaurat). Agentul de reducere este orice substanță capabilă să doneze electroni (oxideaza).
Care sunt reacțiile redox?
Reacțiile redox conduc la o modificare de oxidare state atomilor substanțe care intră în reacție. Oxidarea determină o creștere a gradului de oxidare și restaurare - coborâre. În chimie anorganică, astfel de procese pot fi considerate ca deplasarea unui electron dintr-un reductant la oxidant.
Există mai multe tipuri de reacții redox:
1. La reacțiile atomi intermoleculare, schimbarea gradului de oxidare, sunt în același material. Un exemplu este reacția producerea dioxidului de sulf dintr-un dioxid de sulf.
2. In reacțiile intramoleculare ale atomilor care modifică starea de oxidare sunt în diferite substanțe. De exemplu: reacția de descompunere a dicromat de amoniu.
3. autooxidare sau de auto-vindecare. In astfel de reacții, agent reducător și agent de oxidare este o singură substanță.
Metoda Electronic Balance
În aproape toate ecuațiile de redox foarte dificil de a găsi factori pentru a egaliza partea din stânga și din dreapta. Pentru aceasta a fost inventat printr-o metodă simplă și elegantă a echilibrului electronic. Esența ei constă în faptul că numărul de donator de electroni întotdeauna egală cu suma primită.
Să presupunem că o reacție pentru producerea de alumină. Pentru a începe, trebuie să identifice în mod corect gradul de oxidare a substanțelor de atomi din partea stângă și dreaptă a ecuației. Gradul de oxidare a oxigenului și a aluminiului schimbat. Contoriza numărul de electroni care au dat aluminiu. Acesta ar trebui să fie egal cu numărul de electroni care au oxigen. două ecuații necesare pentru a face și să livreze rapoartele dorite, astfel încât acestea au transformat în identitate. Acești coeficienți și trebuie să fie înlocuit în ecuația originală cu atomi adecvați.