Circuit de celule galvanice, principiul de funcționare, utilizarea
Pentru a cartografia celula, este necesar să se înțeleagă principiul acțiunilor sale, caracteristicile structurale.
Consumatorii plătesc rareori atenție la baterie și bateria în timp ce aceste surse de energie sunt cele mai populare.

surse chimice
Ce este o celulă galvanică? Sistemul se bazează pe electrolit său. Dispozitivul include un recipient mic, care este un electrolit adsorbit de material separator. Mai mult decât atât, circuitul celor două elemente galvanice presupune catod și anod. Care este numele unei astfel de celule galvanice? Circuitul care leagă două metalul presupune prezența unei reacții redox.
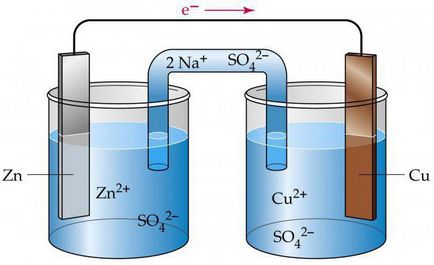
Celula electrochimică elementară
Aceasta presupune existența a două plăci sau bare din metale diferite, care sunt scufundate într-o soluție puternic electrolit. În timpul funcționării celulei electrochimice, procedeul de oxidare anod este realizat asociat cu impact de electroni.
La catod - restaurarea, însoțită de adoptarea particulelor negative. Există un transfer de electroni printr-un circuit extern la oxidant al reducator.
celule electrochimice EXEMPLU
Pentru a face circuite electronice de celule electrochimice, este necesar să se cunoască valoarea potențialului de electrod standard de. Analyse varianta cupru-zinc celule galvanice care funcționează pe baza energiei degajate în timpul reacției de cupru cu sulfat de zinc.
Această celulă electrochimică, circuitul care va fi prezentată mai jos, menționată ca element-Jacobi Daniel. Acesta include o placă de cupru, care este imersată într-o soluție de sulfat de cupru (electrod de cupru), și constă dintr-o placă de zinc, situat într-o soluție de sulfat (electrod de zinc) său. Soluțiile de contact reciproc, dar pentru a evita elementul lor de amestecare utilizat într-o partiție realizată dintr-un material poros.
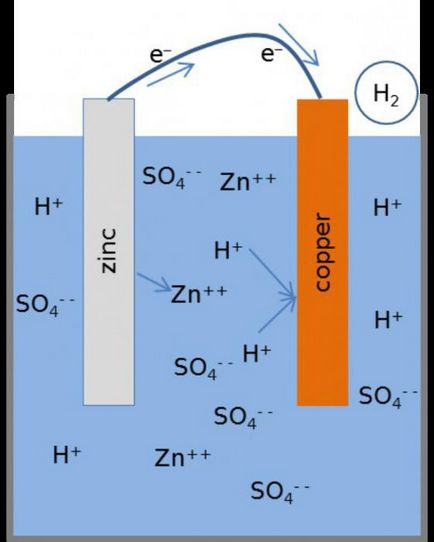
Principiul de funcționare
Cum celula electrochimică, circuitul are forma Zn ½ ZnSO4 ½½ CuSO4 ½ de Cu? În timpul funcționării sale, atunci când circuitul electric este închis, există un proces de oxidare de zinc metalic.
La suprafața sa de contact cu saramură observate atomi de conversie în cationii Zn2 +. Procesul este însoțit de eliberarea de electroni „liberi“, care se deplasează printr-un circuit extern.
Reacția are loc la electrodul de zinc, poate fi reprezentat după cum urmează:
Recuperarea cationilor metalici se realizează la un electrod de cupru. Particulele negative care cad aici cu electrodul de zinc, sunt combinate cu cationi de cupru, grăbind-le sub formă de metal. Procesul este după cum urmează:
Dacă adăugăm două reacții, discutate mai sus, se obține ecuația generală care descrie funcționarea elementului galvanic zinc-cupru.
Actele de zinc ca un electrod anod, catod este cupru. Celulele electrochimice moderne și baterii implică utilizarea uneia din soluția de electrolit, care se extinde domeniul de aplicare, ceea ce face operarea lor mai confortabil și convenabil.
Soiurile de celule electrochimice
Cele mai frecvente sunt considerate celule carbon-zinc. Ei folosesc un colector de curent de carbon pasiv contactarea anod, care acționează oxid în mangan (4). electrolit clorura de amoniu este utilizat într-o formă de pastă.
El nu se execută, de aceea a numit-o celulă uscată galvanic. Caracteristica sa este abilitatea de a „recupera“ în timpul operațiunii, care afectează în mod pozitiv durata perioadei de aplicare. Astfel de celule electrochimice sunt ieftine, dar de mică putere. La temperaturi mai scăzute reduc eficiența și când crește treptat uscare electrolit.
Celulele Alkaline implică utilizarea unei soluții alcaline, deci au o mulțime de aplicații.
In celulele litiu actioneaza ca un metal activ anod, care afectează în mod pozitiv durata de viață utilă. Litiu are un potențial de electrod negativ, prin urmare, cu dimensiuni mici elemente similare au o tensiune nominală maximă. Printre deficiențele unor astfel de sisteme este posibil să se aloce un preț ridicat. Surse de alimentare litiu autopsii este exploziv.
concluzie
Principiul de funcționare a oricărei celule electrochimice se bazeaza pe procesele redox care au loc la catod și anod. În funcție de metal ales soluția de electrolit, schimbarea de viață a celulei, iar magnitudinea tensiunii nominale. În prezent, cererea de litiu, celule de cadmiu având o perioadă suficient de lungă de serviciu său.