acțiune chimică
§ 27. Acțiunea chimică a curentului electric
Soluțiile sărurilor și acizii în apă sau orice alt comportament solvent curent electric și se numesc electroliți sau conductorilor de al doilea tip, în contrast cu conductori metalici, conductorii primului tip menționat.
Curentul electric poate trece printr-un mediu având particule încărcate electric având capacitatea de a muta.
Când săruri dizolvate și de acid în apă sau în orice alt solvent (alcool etilic, benzină, benzen, etc.) Dintre moleculele se imparte in doua parti, numite ioni. o parte este pozitiv, celălalt - o sarcină negativă.
Astfel, spre deosebire de conductorii metalici în care purtătorii electrice sunt electroni, ele sunt ioni în electroliți.
Ionii pot fi simple sau complexe. substanță ion simplă este formată dintr-un singur atom. Ionii, format din câțiva atomi, sunt numite complexe.
Dezintegrarea compușilor chimici în ioni sub influența solventului se numește disociere electrolitica și exprimată prin ecuații chimice convenționale în partea stângă sunt plasate simboluri chimice agenți de dezintegrare, și dreapta - ionii formați din aceste substanțe. De exemplu, ecuația de disociere a sării (clorură de sodiu) poate fi scrisă astfel:
Dacă într-un vas cu un electrolit imersiunea cele două plăci de metal, electrozi care prin fir conduce conectat la bornele sursei de alimentare în curent continuu, din cauza diferenței de potențial dintre electrozi prin electrolit la fluxul de curent cunoscut. Trecerea curentului prin electrolit însoțită de procese chimice, care poartă electrolizei generală din titlu. Situat în electroliți sunt atrase de electrozi, se deplasează în direcții opuse, ionii pozitivi - catod, în timp ce negativ - la anod. Se apropie de catod, ionii pozitivi sunt produse din ea electronii care lipsesc și formează atomi neutri electric. La anod procesul invers are loc: ionii de anod negativ da electronii în exces. De exemplu, în electroliza soluției de clorură de sodiu, se depun pe catod ionii de sodiu pozitivi, iar anodul - ionii de clor negativi (fig. 24).
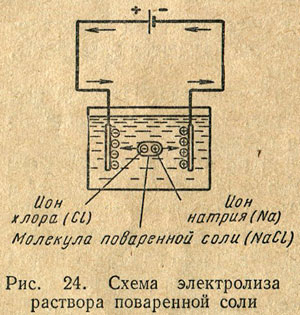
Ca urmare, o trecere continuă a electronilor din catod în ioni și intrarea la anod este susținut de mișcarea electronilor în firele de conectare la sursa de energie electrică la electrozi.
Cu trecerea curentului electric prin electrolit la electrozi li se alocă o anumită cantitate de substanțe conținute într-un compus chimic în electrolit. Dependența materialului selectat pe intensitatea curentului este stabilit legea primului Faraday, care este formulată după cum urmează: Cantitatea de substanță eliberată la electrozi prin trecerea curentului prin electrolitul este direct proporțională cu cantitatea de energie electrică a trecut prin electrolit. Cu trecerea energiei electrice din pandantiv electrolit alocat o anumită cantitate de greutate dintr-o substanță care se numește echivalentul electrochimic al substanței.
În calculele practice pentru a determina cantitatea de energie electrică este mult mai convenabil de a utiliza nu pandantive (k), iar amperajul-ore (Ah).
Un echivalent electrochimică este exprimată în grame, raportat la 1 Ah cantitate electrice (T / a-h), m. E. Determină cantitatea de greutate de material eliberat din electrolit și exprimată în grame, în timp ce trece prin electrolit 1 și · h cantitatea electrică.
Notând Am continuat puterea curentului care circulă prin electrolit în timpul t h un echivalent electrochimică a substanței. - Prin k. determină cantitatea în greutate de substanță în grame g eliberată în acest timp:
Exemplu. În cazul în care curentul care trece prin electrolit în mednokisly 1 și timp de 1 oră la catod este eliberat 1,186 g de cupru, apoi cu un curent de 10 A din aceeași soluție timp de 10 ore evidențiată 1,186 × 10 × 10 = 118,6 g.
Cele mai utilizate pentru electroliza aplicarea unei acoperiri relativ subțiri ale anumitor metale pe de altă parte (galvanizare). Galvanizare este folosit pentru a da articole decorative pentru aspect și de protecție împotriva coroziunii. În acest mod produc placare cu aur, argint placare, placare cu nichel, și așa mai departe. D.
Electroliza este de asemenea utilizat pentru purificare (rafinare) din metale, cum ar fi cuprul. placă de cupru brut obținut prin calcinarea minereului este imersat ca anod într-o soluție de sulfat de cupru baie conținând acidulează cu acid sulfuric pentru a îmbunătăți conductivitatea electrolitului. Cathodes în aceste băi sunt placă subțire de cupru, pe care este depus cupru electrolitic, iar impuritățile depuse pe fundul cuvei.
O metodă foarte frecventă de a produce electrolitici caustice alcaline de sodiu, potasiu și clor, și oxigen și hidrogen.